医薬品業界のDX|安心安全な医薬品製造を可能にする新システム 0

目次
現在、作業効率の向上や環境への配慮などを理由に、さまざまな業界で進められているDX。今回は、日揮グループが開発した、医薬品製造業界のペーパーレスを実現する新システム「HistoHub ®」特集です。
「HistoHub ®」の開発背景には、製造記録書など「紙での保管」が主流な場面が見受けられているという医薬品業界における現状がありました。 そこで、今のバイオ医薬品業界、また開発背景にあったペーパーレスに焦点を当てながら、現状・課題やメリット、新システムを紹介していきます。
バイオ医薬品業界とペーパーレスの課題

まずは医薬品業界の現状と、ペーパーレス化にまつわる課題から見ていきましょう。
バイオ医薬品業界の現状と課題
厚生労働省の規制により、抗体医薬品、ワクチン、再生医療等製品などの生物由来(バイオ)医薬品等 にかかわる製品の文書及び記録は、10年〜30年間の保管が義務付けられていることをご存知でしょうか。
| 第30条(文書及び記録の保管)関係 (2)生物由来医薬品等に係る製品については、製品による感染症が万一発生した場合の調査等を可能とするため、特定生物由来医薬品及び人の血液を原材料として製造される生物由来医薬品に係る製品については、その有効期間に30年を加算した期間、その他の生物由来・細胞組織医薬品に係る製品については、その有効期間に10年を加算した期間記録を保存するものであること。 (引用元:厚生労働省「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の取扱いについて」) |
バイオ医薬品製造に関わる文書及び記録は通常、紙に印刷して保管されています。しかし、1度でその印刷作業が完了するわけではありません。 印字は経年劣化により読みづらくなりますが、そのような文書はデータインテグリティが確保されないためにGMP文書として役に立たなくなります。すなわち、製品の品質を保証できないことに繋がり、販売ができなくなってしまいます。このような品質リスクを防止するため、印字が読めなくなるであろう年数が経つ前にあらかじめ、新たな紙にコピーをする必要があるのです。
たとえば、文書や記録を30年間保存するケースにおいて10年ごとに古くなった文書・記録をコピーする例を考えてみると、単純計算で30年の間に計2回の大規模なコピー操作が発生することになります。またバイオ医薬品製造施設を建設した際には、設計通りに納入したことを証明する文書として5000字ファイルを100冊以上も納品するため、生産の過程だけでなく施設建設時においても膨大な量の紙が必要です。
このように、紙や印刷・コピーにかかるコストの問題だけでなく、印刷やコピー作業・文書管理の煩雑さ、環境への影響なども考えると、医薬品業界でのペーパーレス化は、取り組む価値のある課題といえそうです。
ペーパーレス化が実現しづらい背景
しかし現状、医薬品業界において、製造記録書のペーパーレス化はなかなか進んでいません。背景には、製造記録が電子データで存在するにもかかわらず、製造記録作成・および作成後の承認に「サインもしくは捺印が必要であること」が挙げられますが、それは一体どのような仕組みなのでしょうか。
バイオ医薬品の製造工程
 このようにバイオ医薬品の製造工程では、一度きりで使い捨てるバッグやチューブで構成された「シングルユース機器」が工程ごとに独立して使われています。このシングルユース機器により採取された各工程の製造データは、機器に搭載されている「制御システム」単位で記録される仕組みとなっているため、データを一元して管理することは難しい現状があります。
このようにバイオ医薬品の製造工程では、一度きりで使い捨てるバッグやチューブで構成された「シングルユース機器」が工程ごとに独立して使われています。このシングルユース機器により採取された各工程の製造データは、機器に搭載されている「制御システム」単位で記録される仕組みとなっているため、データを一元して管理することは難しい現状があります。
その結果、「電子データとして採取された記録を紙に印刷したのちに確認・サインする業務フロー」が必要であり、これがペーパーレス化への移行までに時間を要している原因の1つとなっています。
【2選】ペーパーレス化のメリット

では医薬品の製造記録書が従来の紙媒体から電子保存へ変わった場合、どのようなメリットがあるのでしょうか。
不正のリスクを軽減し、安全に薬をつくれる
2020年12月、ジェネリック医薬品メーカーである小林化工が製造・販売する外用薬・抗真菌剤に、睡眠誘導剤が混入する事件+が発生しました。直接の原因は、職員による原料(医薬品)の取違いとチェック体制の不備とされていますが、承認書に記載がない製造工程における製造が常態化してしまうなど、製造管理・品質管理にも問題があった可能性が指摘されています。 (参考:NHK「【詳しく】製薬会社の行政処分相次ぐ メーカーに何が?」)
そのほかにも、医薬品製造・販売の承認書にはない添加物が加えられるなど、承認書と製造実態に相違があった事例は複数あり、2021年に製造不正により業務停止命令を受けた製薬メーカーは8社にのぼっています。
このような事態を受け、厚生労働省による法令遵守体制の整備が進められてきたものの、紙媒体で管理している以上は人間により記載内容が書き換えられる可能性は存在しています。しかし電子データでは、誰かがデータにアクセスをし、内容を改ざんしようとすると履歴が残る設定にすることができ、その結果、いつ・なんの理由で誰が操作したのか、もしくはどの箇所が修正されたのかなどが記録されるようになっています。安心で安全な医薬品製造のためには、電子データによる保存・管理が重要な役割を担えるといえるでしょう。
紙の管理コスト軽減や人員不足解消につながる
製造記録書を電子化した場合、印刷・コピーにおけるインクにかかるコストや紙の管理コストを減らすことができるため、環境面だけでなく経済面でのメリットもあります。紙の管理には人手がかかりますが、ペーパーレスとなることで手間が減り、それ以外の業務に配分を充てることができるでしょう。
【事例】医薬品業界のペーパーレスを実現する「HistoHub®」システム
ここからは、日揮グループが開発したペーパーレス化の新しいシステムについてご紹介します。 医薬品業界でのペーパーレスの課題を克服するべく、また世界的なバイオ医薬品の成長に伴うシングルユース設備の需要拡大に対応するため、日揮グループはシングルユース設備向けの統合データ管理システム、「HistoHub®」 を開発しました。
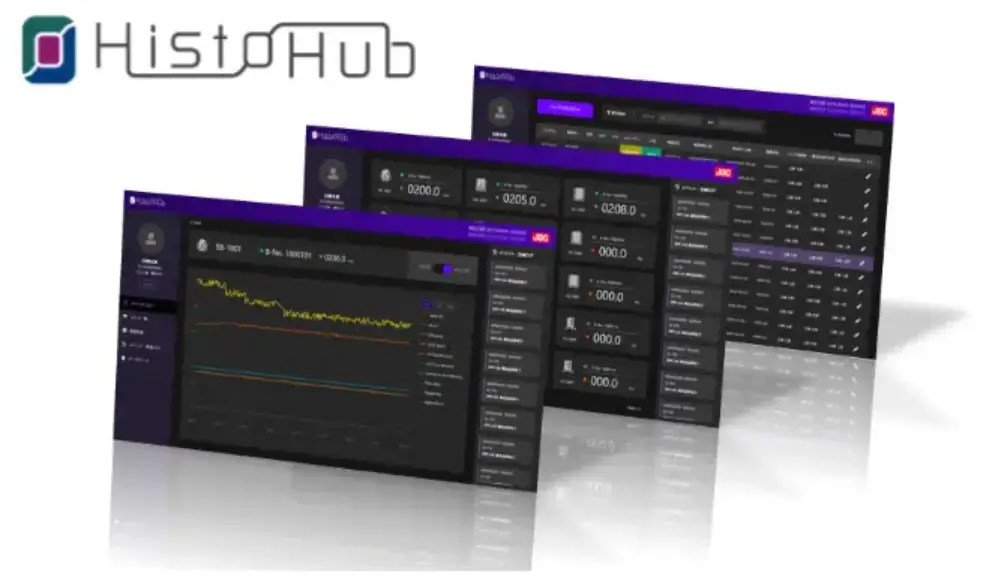
「HistoHub®」はシングルユース設備のGMPデータ*を統合して管理する新しいソフトウェアです。シングルユース機器から製造データを収集し、データベースへの保存・製造記録の作成・レビュー・承認までの一連の作業をパソコン画面のブラウザ上でおこなうことができます(クラウド対応は2024年度以降対応に向け開発予定)。
*GMP:医薬品を製造するための要件をまとめたもの。Good Manufacturing Practiceの頭文字を取った言葉であり、日本語では「医薬品の製造管理及び品質管理の基準」と表現されている。(参照:日本医薬品原薬工業会「GMPとは」)
「Histohub ®」システムの特徴
Histohub ®には、具体的にどのような特徴があるのでしょうか。
製造記録の電子承認機能で ペーパーレス化を実現
 冒頭で紹介したように、Histohub®では「医薬品製造記録」をパソコンの画面上で作成することができます。操作の履歴や警報などの製造データが、あらかじめ設定した製造バッチ*に紐づいて自動的に整理されることで、記録作成者は業務フローに従いながらデータの確認が可能になります。さらにデータを製造記録としてまとめる工程もパソコン上にておこなえるため、紙データとしての印刷が不要になるのです。
冒頭で紹介したように、Histohub®では「医薬品製造記録」をパソコンの画面上で作成することができます。操作の履歴や警報などの製造データが、あらかじめ設定した製造バッチ*に紐づいて自動的に整理されることで、記録作成者は業務フローに従いながらデータの確認が可能になります。さらにデータを製造記録としてまとめる工程もパソコン上にておこなえるため、紙データとしての印刷が不要になるのです。
また、まとめられた製造記録のレビューや承認は、製造管理責任者・品質保証責任者などあらかじめ設定したユーザーのみが対応でき、レビュー中にコメントを追記して差し戻したり、コメントの対応結果をリストに残したりと、パソコン上で、従来の紙の記録のように電子記録を扱うこともできます。
記録を作成した人と同じ人物がそのまま承認作業をおこなってしまうことは、チェック体制の不備・不十分な管理体制であるといえます。記録の作成者とは別の人間、つまり、あらかじめ設定したユーザーがレビュー・承認に対応できることは、データインテグリティを守るために必要な機能です。
*製造バッチ…医薬品を製造するなかで、1つ以上の製造工程を「ひとまとめの量でまとめたもの」を指す。そのひとかたまりは、品質が同質であるという保証ができる。
データの一括管理が可能に

従来の市販ソフトのシステム構成の場合は、データ管理機能のカスタマイズや、様々な通信規格への対応が必要であるといった課題がありました。たとえば、決まった仕様で低価格版として市販されているシステムでは、システムの機能が本来の目的に合っていなくても、カスタマイズできる仕様になっていません。そのため、別のシステムを1から設計開発し、市販ソフトとの連携検証も必要といった、手間のかかる作業が必須でした。
それ以外にも、市販ソフトは使用せずにユーザーとコミュニケーションを取りながら設計図書にまとめるケースもありますが、ソフト開発会社への発注・作成後にイメージの相違等からソフトの大改造が発生するなど、非効率的な動きが見受けられてしまうこともあります。
一方Histohub®では、製造バッチ毎に製造記録を電子的に出力し、各製造バッチ内のデータを一括で管理するため、様々なサプライヤ・型式のシングルユース機器が組み合わされたバイオ医薬品製造設備であっても対応が可能です。
直観的な操作を可能にするUI/UX
また操作性を重視したUI(ユーザーインターフェース)で構成されているため、必要なデータを短時間で参照することが可能であり、業務の効率アップも図ることができます。
まとめ
医薬品業界のペーパーレス化を実現すると、紙の印刷・管理コストや管理工数の削減になるだけでなく、データ改ざんのリスク軽減にもつながり、さらなる安心安全な医薬品製造ができます。紙を使用しないことにより、地球環境の保全にも資することが可能でしょう。 また、紙データでは過去の製造記録を遡りたい際や、該当の情報を探したい際、手間や時間を要してしまいます。ペーパーレスへの移行は、作業効率の好転をはかるためにも、医薬品業界のみならず多くの業界に共通している課題かもしれません。
新システム「Histohub®」は、医薬品業界のペーパーレス化を実現できることに加え、製品の製造過程における安全性も担保できるシステムです。 詳細は、ホームページおよびニュースリリースからご確認ください。
※より詳しい資料をご覧になりたい場合は、以下から「Histohub®」の紹介スライド一式をダウンロードできます。
資料ダウンロード hbspt.cta.load(20511294, ‘5d3f961d-15d4-4c98-8056-9b85804b0870’, {“useNewLoader”:”true”,”region”:”na1″});
HistoHub® Web Site(公式)ニュースリリース(日揮ホールディングスHP内)


COMMENT
現在コメントはございません。